Kaasaegse meditsiini valdkonnas on antibiootikumid osutunud üheks olulisemaks edusammuks, vähendades dramaatiliselt mikroobsete infektsioonidega seotud esinemissagedust ja suremust. Nende võime muuta bakteriaalsete infektsioonide kliinilisi tulemusi on pikendanud lugematute patsientide eluiga. Antibiootikumid on kriitilise tähtsusega keeruliste meditsiiniliste protseduuride, sealhulgas operatsioonide, implantaatide paigaldamise, siirdamise ja keemiaravi puhul. Siiski on antibiootikumiresistentsete patogeenide teke tekitanud üha suuremat muret, vähendades nende ravimite efektiivsust aja jooksul. Antibiootikumiresistentsuse juhtumeid on dokumenteeritud kõigis antibiootikumide kategooriates, kuna mikroobide mutatsioonid toimuvad. Antimikroobsete ravimite avaldatav selektsioonisurve on aidanud kaasa resistentsete tüvede tekkele, mis on oluliseks väljakutseks ülemaailmsele tervisele.
Antimikroobse resistentsuse pakilise probleemi vastu võitlemiseks on oluline rakendada tõhusaid nakkustõrje poliitikaid, mis piiravad resistentsete patogeenide levikut ja vähendavad antibiootikumide kasutamist. Lisaks on tungiv vajadus alternatiivsete ravimeetodite järele. Hüperbaariline hapnikravi (HBOT) on selles kontekstis paljulubavaks meetodiks osutunud, hõlmates 100% hapniku sissehingamist kindla rõhutaseme juures teatud aja jooksul. Positsioneerituna kas primaarse või täiendava ravina infektsioonide korral võib HBOT pakkuda uut lootust antibiootikumiresistentsete patogeenide põhjustatud ägedate infektsioonide ravis.
Seda ravi kasutatakse üha enam esmase või alternatiivse ravina mitmesuguste seisundite, sealhulgas põletiku, süsinikmonooksiidi mürgistuse, krooniliste haavade, isheemiliste haiguste ja infektsioonide korral. HBOT-i kliinilised rakendused infektsioonide ravis on sügavad, pakkudes patsientidele hindamatuid eeliseid.

Hüperbaarilise hapnikravi kliinilised rakendused infektsioonide korral
Praegused tõendid toetavad kindlalt HBOT-i kasutamist nii iseseisva kui ka täiendava ravina, pakkudes nakatunud patsientidele märkimisväärset kasu. HBOT-i ajal võib arteriaalse vere hapnikurõhk tõusta 2000 mmHg-ni ja sellest tulenev kõrge hapniku-koerõhu gradient võib tõsta kudede hapnikutaseme 500 mmHg-ni. Sellised toimed on eriti väärtuslikud isheemilises keskkonnas täheldatud põletikuliste reaktsioonide ja mikrotsirkulatsiooni häirete paranemise soodustamisel, samuti kompartmentsündroomi ravis.
HBOT võib mõjutada ka immuunsüsteemist sõltuvaid seisundeid. Uuringud näitavad, et HBOT võib pärssida autoimmuunseid sündroome ja antigeenist põhjustatud immuunreaktsioone, aidates säilitada siiriku taluvust, vähendades lümfotsüütide ja leukotsüütide ringlust ning moduleerides samal ajal immuunreaktsioone. Lisaks HBOTtoetab paranemistkrooniliste nahakahjustuste korral, stimuleerides angiogeneesi, mis on kriitilise tähtsusega protsess parema taastumise jaoks. See ravi soodustab ka kollageenimaatriksi moodustumist, mis on haavade paranemise oluline etapp.
Erilist tähelepanu tuleb pöörata teatud infektsioonidele, eriti sügavatele ja raskesti ravitavatele infektsioonidele, nagu nekrotiseeriv fastsiit, osteomüeliit, kroonilised pehmete kudede infektsioonid ja nakkuslik endokardiit. Üks HBOT-i levinumaid kliinilisi rakendusi on naha-pehmete kudede infektsioonid ja osteomüeliit, mis on seotud madala hapnikusisaldusega ja mida sageli põhjustavad anaeroobsed või resistentsed bakterid.
1. Diabeetilised jalainfektsioonid
Diabeetiline jalgHaavandid on diabeetikute seas levinud tüsistus, mis mõjutab kuni 25% sellest populatsioonist. Nendes haavandites tekivad sageli infektsioonid (moodustades 40–80% juhtudest) ning need suurendavad haigestumust ja suremust. Diabeetilised jalainfektsioonid (DFI-d) koosnevad tavaliselt polümikroobsetest infektsioonidest, mille käigus tuvastatakse mitmesuguseid anaeroobseid bakteriaalseid patogeene. Diabeetikutel võivad haavade paranemist takistada mitmesugused tegurid, sealhulgas fibroblastide funktsioonihäired, kollageeni moodustumise probleemid, rakulised immuunmehhanismid ja fagotsüütide funktsioon. Mitmed uuringud on tuvastanud naha hapnikuga varustamise häire kui DFI-dega seotud amputatsioonide tugeva riskiteguri.
Ühe praeguse DFI ravi võimalusenaOn teatatud, et HBOT parandab oluliselt diabeetiliste jalahaavandite paranemismäära, vähendades seega amputatsioonide ja keeruliste kirurgiliste sekkumiste vajadust. See mitte ainult ei minimeeri ressursimahukate protseduuride, näiteks klapioperatsioonide ja nahasiirdamise, vajadust, vaid pakub ka madalamaid kulusid ja minimaalseid kõrvaltoimeid võrreldes kirurgiliste võimalustega. Cheni jt uuring näitas, et enam kui 10 HBOT-seanssi viisid diabeetikutel haavade paranemise määra 78,3% paranemiseni.
2. Nekrotiseerivad pehmete kudede infektsioonid
Nekrotiseerivad pehmete kudede infektsioonid (NSTI-d) on sageli polümikroobsed, tavaliselt tekivad aeroobsete ja anaeroobsete bakteriaalsete patogeenide kombinatsioonist ning on sageli seotud gaaside tootmisega. Kuigi NSTI-d on suhteliselt haruldased, on nende kiire progresseerumise tõttu kõrge suremus. Õigeaegne ja asjakohane diagnoosimine ning ravi on soodsate tulemuste saavutamise võtmeks ning HBOT-d on soovitatud NSTI-de ravis täiendava meetodina. Kuigi HBOT-i kasutamise osas NSTI-de korral on endiselt vaidlusi prospektiivsete kontrollitud uuringute puudumise tõttu,tõendid viitavad sellele, et see võib olla seotud NSTI patsientide parema ellujäämismäära ja elundite säilimisegaRetrospektiivne uuring näitas HBOT-d saavate NSTI-patsientide suremuse olulist vähenemist.
1.3 Kirurgilise koha infektsioonid
KKI-sid saab liigitada infektsiooni anatoomilise asukoha alusel ning need võivad tekkida erinevatest patogeenidest, sealhulgas nii aeroobsetest kui ka anaeroobsetest bakteritest. Vaatamata infektsioonitõrje meetmete edusammudele, nagu steriliseerimistehnikad, profülaktiliste antibiootikumide kasutamine ja kirurgiliste praktikate täiustumine, on KKI-d endiselt püsiv tüsistus.
Ühes olulises ülevaates on uuritud HBOT-i efektiivsust sügavate kirurgiliste infektsioonide (SSI) ennetamisel neuromuskulaarse skolioosi operatsiooni ajal. Preoperatiivne HBOT võib oluliselt vähendada SSI-de esinemissagedust ja soodustada haavade paranemist. See mitteinvasiivne ravi loob keskkonna, kus haavakudede hapnikutase on kõrgenenud, mida on seostatud oksüdatiivse surmava toimega patogeenide vastu. Lisaks tegeleb see madala vere- ja hapnikutasemega, mis aitavad kaasa SSI-de tekkele. Lisaks teistele infektsioonikontrolli strateegiatele on HBOT-i soovitatav eriti puhaste ja saastunud operatsioonide, näiteks kolorektaalsete protseduuride puhul.
1.4 Põletused
Põletused on vigastused, mis on põhjustatud äärmisest kuumusest, elektrivoolust, kemikaalidest või kiirgusest ning võivad põhjustada suurt haigestumust ja suremust. HBOT on kasulik põletuste ravis, suurendades kahjustatud kudede hapnikusisaldust. Kuigi loomkatsed ja kliinilised uuringud on andnud vastakaid tulemusiHBOT-i efektiivsus põletuste ravisUuring, milles osales 125 põletushaavu saanud patsienti, näitas, et HBOT ei avaldanud olulist mõju suremusele ega teostatud operatsioonide arvule, kuid vähendas keskmist paranemisaega (19,7 päeva võrreldes 43,8 päevaga). HBOT-i integreerimine tervikliku põletusraviga võiks põletushaavu saanud patsientidel sepsist tõhusalt kontrollida, mis lühendaks paranemisaega ja vähendaks vedelikuvajadust. HBOT-i rolli ulatuslike põletuste ravis kinnitamiseks on aga vaja täiendavaid ulatuslikke prospektiivseid uuringuid.
1.5 Osteomüeliit
Osteomüeliit on luu või luuüdi infektsioon, mida sageli põhjustavad bakteriaalsed patogeenid. Osteomüeliidi ravimine võib olla keeruline luude suhteliselt kehva verevarustuse ja antibiootikumide piiratud tungimise tõttu luuüdisse. Kroonilist osteomüeliiti iseloomustavad püsivad patogeenid, kerge põletik ja nekrootilise luukoe moodustumine. Refraktaarne osteomüeliit viitab kroonilistele luuinfektsioonidele, mis jätkuvad või korduvad hoolimata sobivast ravist.
On näidatud, et HBOT parandab oluliselt hapnikutaset nakatunud luukoes. Arvukad juhtumiuuringud ja kohortuuringud näitavad, et HBOT parandab osteomüeliidi patsientide kliinilisi tulemusi. See näib toimivat erinevate mehhanismide kaudu, sealhulgas metaboolse aktiivsuse suurendamine, bakteriaalsete patogeenide pärssimine, antibiootiliste efektide tugevdamine, põletiku minimeerimine ja paranemise soodustamine.protsessid. Pärast HBOT-i ilmnevad 60–85%-l kroonilise refraktaarse osteomüeliidiga patsientidest infektsiooni pärssimise tunnused.
1.6 Seeninfektsioonid
Üle maailma kannatab üle kolme miljoni inimese krooniliste või invasiivsete seeninfektsioonide all, mis põhjustavad igal aastal üle 600 000 surmajuhtumi. Seeninfektsioonide ravi tulemusi kahjustavad sageli sellised tegurid nagu muutunud immuunseisund, põhihaigused ja patogeenide virulentsusomadused. HBOT on oma ohutuse ja mitteinvasiivse olemuse tõttu muutumas atraktiivseks ravivõimaluseks raskete seeninfektsioonide korral. Uuringud näitavad, et HBOT võib olla efektiivne seenpatogeenide, näiteks Aspergillus ja Mycobacterium tuberculosis, vastu.
HBOT soodustab seenevastast toimet, pärssides Aspergillus'e biokile moodustumist, kusjuures suurenenud efektiivsust on täheldatud tüvedel, millel puuduvad superoksiiddismutaasi (SOD) geenid. Seeninfektsioonide ajal tekkiv hüpoksiline seisund seab seenevastaste ravimite manustamise keeruliseks, mistõttu on HBOT-i suurenenud hapnikutase potentsiaalselt kasulik sekkumine, kuigi edasised uuringud on vajalikud.
HBOT-i antimikroobsed omadused
HBOT-i loodud hüperoksiline keskkond käivitab füsioloogilisi ja biokeemilisi muutusi, mis stimuleerivad antibakteriaalseid omadusi, muutes selle tõhusaks täiendavaks raviks infektsioonide korral. HBOT-il on märkimisväärne toime aeroobsete bakterite ja peamiselt anaeroobsete bakterite vastu selliste mehhanismide kaudu nagu otsene bakteritsiidne toime, immuunvastuste tugevdamine ja sünergiline toime spetsiifiliste antimikroobsete ainetega.
2.1 HBOT-i otsene antibakteriaalne toime
HBOT-i otsene antibakteriaalne toime on suuresti omistatud reaktiivsete hapnikuühendite (ROS) tekkele, mille hulka kuuluvad superoksiidi anioonid, vesinikperoksiid, hüdroksüülradikaalid ja hüdroksüülioonid – kõik need tekivad rakulise metabolismi käigus.
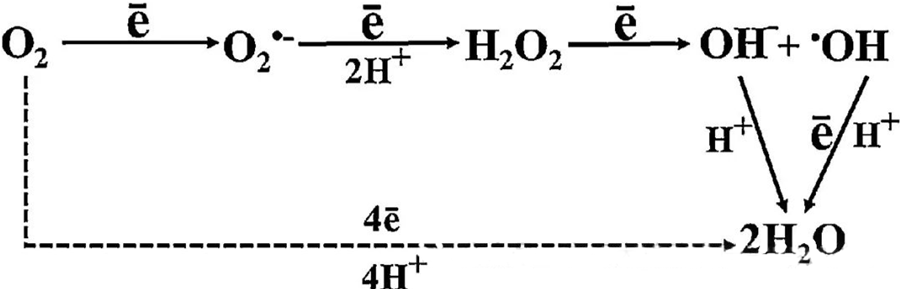
O₂ ja rakuliste komponentide vastastikmõju on oluline, et mõista, kuidas ROS rakkudes moodustub. Teatud tingimustes, mida nimetatakse oksüdatiivseks stressiks, on ROS-i moodustumise ja lagunemise vaheline tasakaal häiritud, mis viib ROS-i taseme tõusuni rakkudes. Superoksiidi (O₂⁻) tootmist katalüüsib superoksiiddismutaas, mis seejärel muundab O₂⁻ vesinikperoksiidiks (H₂O₂). Seda muundumist võimendab veelgi Fentoni reaktsioon, mis oksüdeerib Fe²⁺ hüdroksüülradikaalideks (·OH) ja Fe³⁺, käivitades seeläbi ROS-i moodustumise ja rakkude kahjustuse kahjuliku redoksjärjestuse.
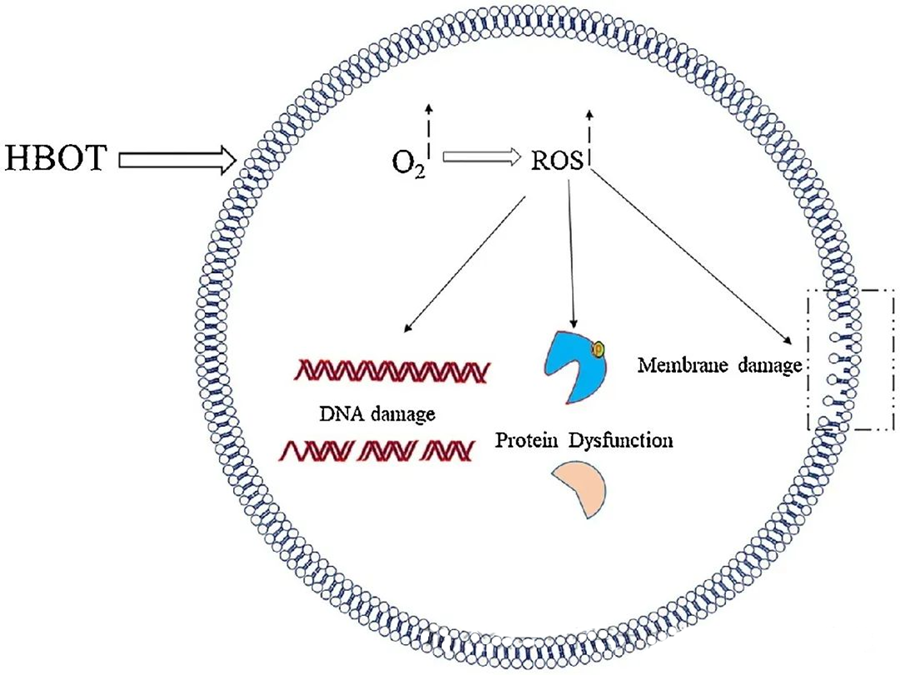
ROS-i toksiline mõju on suunatud kriitilistele rakukomponentidele, nagu DNA, RNA, valgud ja lipiidid. Märkimisväärne on see, et DNA on H₂O₂-vahendatud tsütotoksilisuse peamine sihtmärk, kuna see lõhub deoksüriboosi struktuure ja kahjustab aluskoostisi. ROS-i põhjustatud füüsiline kahjustus ulatub DNA heeliksi struktuurini, mis võib olla ROS-i poolt käivitatud lipiidide peroksüdatsiooni tagajärg. See rõhutab ROS-i kõrgenenud taseme kahjulikke tagajärgi bioloogilistes süsteemides.
ROS-i antimikroobne toime
ROS-il on oluline roll mikroobide kasvu pärssimisel, nagu on näidatud HBOT-indutseeritud ROS-i tekke kaudu. ROS-i toksiline mõju on otseselt suunatud rakulistele koostisosadele, nagu DNA, valgud ja lipiidid. Aktiivse hapniku liigi kõrge kontsentratsioon võib lipiide otseselt kahjustada, mis viib lipiidide peroksüdatsioonini. See protsess kahjustab rakumembraanide terviklikkust ja sellest tulenevalt ka membraaniga seotud retseptorite ja valkude funktsionaalsust.
Lisaks läbivad valgud, mis on samuti ROS-i olulised molekulaarsed sihtmärgid, spetsiifilisi oksüdatiivseid modifikatsioone erinevates aminohappejääkides, nagu tsüsteiin, metioniin, türosiin, fenüülalaniin ja trüptofaan. Näiteks on näidatud, et HBOT indutseerib oksüdatiivseid muutusi mitmetes E. coli valkudes, sealhulgas elongatsioonifaktoris G ja DnaK-s, mõjutades seeläbi nende rakulisi funktsioone.
Immuunsuse tugevdamine HBOT-i kaudu
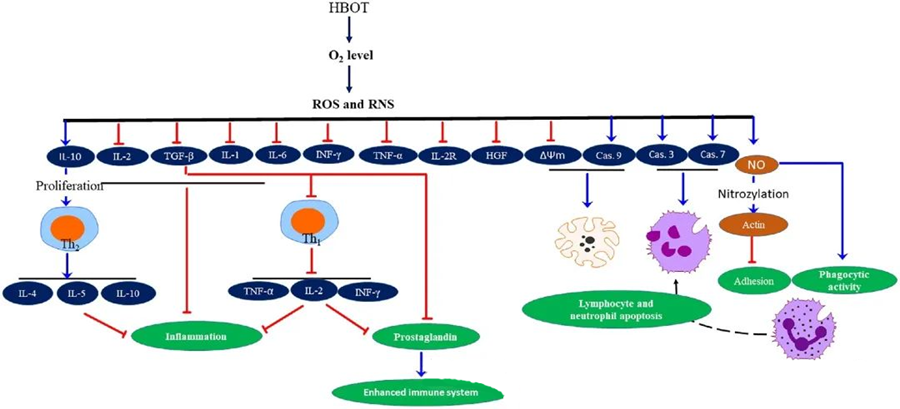
HBOT-i põletikuvastased omadusedon dokumenteeritud, mis osutuvad oluliseks koekahjustuste leevendamisel ja infektsiooni progresseerumise pärssimisel. HBOT mõjutab oluliselt tsütokiinide ja teiste põletikuregulaatorite ekspressiooni, mõjutades immuunvastust. Erinevad eksperimentaalsed süsteemid täheldasid pärast HBOT-i erinevaid muutusi geeniekspressioonis ja valkude genereerimises, mis kas suurendavad või vähendavad kasvufaktorite ja tsütokiinide toimet.
HBOT-protsessi käigus vallandab suurenenud O₂ tase mitmesuguseid rakulisi reaktsioone, näiteks pärssides põletikuliste mediaatorite vabanemist ning soodustades lümfotsüütide ja neutrofiilide apoptoosi. Kokkuvõttes tugevdavad need toimingud immuunsüsteemi antimikroobseid mehhanisme, hõlbustades seeläbi infektsioonide paranemist.
Lisaks näitavad uuringud, et suurenenud O₂ tase HBOT-i ajal võib vähendada põletikuliste tsütokiinide, sealhulgas interferoon-gamma (IFN-γ), interleukiin-1 (IL-1) ja interleukiin-6 (IL-6) ekspressiooni. Need muutused hõlmavad ka CD4:CD8 T-rakkude suhte vähenemist ja teiste lahustuvate retseptorite moduleerimist, mis lõppkokkuvõttes tõstab interleukiin-10 (IL-10) taset, mis on põletiku vastu võitlemiseks ja paranemise soodustamiseks ülioluline.
HBOT-i antimikroobne toime on läbi põimunud keerukate bioloogiliste mehhanismidega. On teatatud, et nii superoksiid kui ka kõrgenenud rõhk soodustavad vastuoluliselt HBOT-i indutseeritud antibakteriaalset aktiivsust ja neutrofiilide apoptoosi. Pärast HBOT-i suurendab hapnikutaseme märkimisväärne tõus neutrofiilide bakteritsiidset võimet, mis on immuunvastuse oluline komponent. Lisaks pärsib HBOT neutrofiilide adhesiooni, mida vahendab neutrofiilide β-integriinide interaktsioon endoteelirakkude rakkudevaheliste adhesioonimolekulidega (ICAM). HBOT pärsib neutrofiilide β-2 integriini (Mac-1, CD11b/CD18) aktiivsust lämmastikoksiidi (NO) vahendatud protsessi kaudu, aidates kaasa neutrofiilide migratsioonile nakkuskohta.
Tsütoskeleti täpne ümberkorraldamine on neutrofiilide tõhusaks patogeenide fagotsüütimiseks vajalik. On näidatud, et aktiini S-nitrosüülimine stimuleerib aktiini polümerisatsiooni, mis potentsiaalselt hõlbustab neutrofiilide fagotsüütilist aktiivsust pärast HBOT-eeltöötlust. Lisaks soodustab HBOT inimese T-rakuliinides apoptoosi mitokondriaalsete radade kaudu, kusjuures on teatatud lümfotsüütide kiirenenud surmast pärast HBOT-i. Kaspaas-9 blokeerimine – ilma kaspaas-8 mõjutamata – on näidanud HBOT-i immunomoduleerivat toimet.
HBOT-i sünergistlik toime antimikroobsete ainetega
Kliinilistes rakendustes kasutatakse HBOT-d sageli koos antibiootikumidega infektsioonide tõhusaks raviks. HBOT-i ajal saavutatav hüperoksiline seisund võib mõjutada teatud antibiootikumide efektiivsust. Uuringud näitavad, et teatud bakteritsiidsed ravimid, nagu β-laktaamid, fluorokinoloonid ja aminoglükosiidid, toimivad mitte ainult omaste mehhanismide kaudu, vaid tuginevad osaliselt ka bakterite aeroobsele metabolismile. Seetõttu on hapniku olemasolu ja patogeenide metaboolsed omadused antibiootikumide terapeutilise toime hindamisel üliolulised.
Olulised tõendid on näidanud, et madal hapnikusisaldus võib suurendada Pseudomonas aeruginosa resistentsust piperatsilliini/tasobaktaami suhtes ning et madal hapnikusisaldus aitab kaasa ka Enterobacter cloacae suurenenud resistentsusele asitromütsiini suhtes. Vastupidiselt võivad teatud hüpoksilised seisundid suurendada bakterite tundlikkust tetratsükliinantibiootikumide suhtes. HBOT on elujõuline täiendav ravimeetod, indutseerides aeroobset metabolismi ja reoksügeniseerides hüpoksiliselt nakatunud kudesid, suurendades seejärel patogeenide tundlikkust antibiootikumide suhtes.
Prekliinilistes uuringutes vähendas HBOT-i kombinatsioon – mida manustati kaks korda päevas 8 tunni jooksul rõhul 280 kPa – koos tobramütsiiniga (20 mg/kg/päevas) oluliselt bakterite hulka Staphylococcus aureus'e infektsioosse endokardiidi korral. See näitab HBOT-i potentsiaali abiravina. Edasised uuringud on näidanud, et 37 °C ja 3 ATA rõhu all 5 tunni jooksul suurendas HBOT märkimisväärselt imipeneemi toimet makrofaagidega nakatunud Pseudomonas aeruginosa vastu. Lisaks leiti, et HBOT-i kombineeritud ravi tsefasoliiniga osutus loommudelites Staphylococcus aureus'e osteomüeliidi ravis efektiivsemaks kui ainult tsefasoliin.
HBOT suurendab oluliselt ka tsiprofloksatsiini bakteritsiidset toimet Pseudomonas aeruginosa biokilede vastu, eriti pärast 90-minutilist kokkupuudet. See tugevnemine on tingitud endogeensete reaktiivsete hapnikuühendite (ROS) moodustumisest ja näitab peroksidaasi-defektsete mutantide suurenenud tundlikkust.
Metitsilliiniresistentse Staphylococcus aureus'e (MRSA) põhjustatud pleuriidi mudelites näitas vankomütsiini, teikoplaniini ja linesoliidi koostoime HBOT-iga oluliselt suurenenud efektiivsust MRSA vastu. Metronidasool, antibiootikum, mida laialdaselt kasutatakse raskete anaeroobsete ja polümikroobsete infektsioonide, näiteks diabeetiliste jalainfektsioonide (DFI) ja kirurgilise haava infektsioonide (SSI) ravis, on näidanud anaeroobsetes tingimustes suuremat antimikroobset efektiivsust. Tulevased uuringud on õigustatud, et uurida HBOT-i ja metronidasooliga kombineeritud sünergilist antibakteriaalset toimet nii in vivo kui ka in vitro tingimustes.
HBOT-i antimikroobne efektiivsus resistentsete bakterite vastu
Resistentsete tüvede evolutsiooni ja levikuga kaotavad traditsioonilised antibiootikumid aja jooksul sageli oma efektiivsuse. Lisaks võib HBOT osutuda oluliseks multiresistentsete patogeenide põhjustatud infektsioonide ravis ja ennetamisel, olles kriitilise tähtsusega strateegiaks antibiootikumravi ebaõnnestumise korral. Arvukad uuringud on teatanud HBOT-i olulisest bakteritsiidsest toimest kliiniliselt olulistele resistentsetele bakteritele. Näiteks 90-minutiline HBOT-seanss 2 ATM juures vähendas oluliselt MRSA kasvu. Lisaks on HBOT suhte mudelites suurendanud erinevate antibiootikumide antibakteriaalset toimet MRSA-infektsioonide vastu. Aruanded on kinnitanud, et HBOT on efektiivne OXA-48-d tootva Klebsiella pneumoniae põhjustatud osteomüeliidi ravis ilma täiendavate antibiootikumide vajaduseta.
Kokkuvõttes kujutab hüperbaariline hapnikravi endast mitmetahulist lähenemisviisi infektsioonide tõrjeks, tugevdades immuunvastust ja võimendades samal ajal olemasolevate antimikroobsete ainete efektiivsust. Põhjaliku uurimis- ja arendustegevuse abil on sellel potentsiaal leevendada antibiootikumiresistentsuse mõjusid, pakkudes lootust käimasolevas võitluses bakteriaalsete infektsioonide vastu.
Postituse aeg: 28. veebruar 2025

